 |
| Todo es Materia |
Quimica
En este blog encontraras grandes posibilidades de investigaciones acerca de la Materia y sus componentes ¿Qué es la materia? A qui vas a encontrar una muy buena explicación de que es la materia y en que formas la podemos encontrar
jueves, 8 de septiembre de 2011
¿Qué es la materia?
El compañero que se sienta junto a vosotros está constituido por materia, lo mismo que la silla en la que se sienta, la mesa que usa para escribir y las hojas de papel que emplea para tomar apuntes. Reciben el nombre de cuerpos a una porción de materia, delimitada por unas fronteras definidas, como un folio, el lápiz o la goma de borrar; varios cuerpos constituyen un sistema material.
Aunque todos los cuerpos están formados por materia, la materia que los forma no es igual, ya que hay distintas clases de materia: la materia que forma el papel es distinta de la que forma el agua que bebemos o de la que constituye el vaso que contiene el agua. La materia que forma el asiento de la silla es distinta de la que forma sus patas o de la que forma el suelo en el que se apoya. Cada una de las distintas formas de materia que constituyen los cuerpos recibe el nombre de sustancia. El agua, el vidrio, la madera, la pintura ... son distintos tipos de sustancias.


¿propiedades de la materia?
Casi siempre que miramos a nuestro alrededor, podemos distinguir las distintas clases de materia que forman los cuerpos que nos rodean. Así distinguimos la madera, el plástico y la pintura de la silla que usamos para sentarnos, el vidrio y el aluminio de la ventana, etc. Sabemos que todas esassustancias son materia y que cada una de ellas es distinta a las demás. Si todas son materia, han de tener algo en común, alguna propiedad que nos permite afirmar que todas ellas son materia. Por otro lado, como podemos distinguir una sustancia de otra, también debe haber algo que nos permite diferenciarlas. Ese algo que nos permite identificar y distinguir las cosas recibe el nombre de propiedad. Propiedad es una característica o atributo de un objeto o una sustancia que nos permite clasificarla como igual o distinta a otra.
Densidad
La densidad es una propiedad física de las sustancias que relaciona su masa con el volumen, por lo tanto se considera una unidad derivad a. Se representa con la letra D Para determinar la densidad de un sólido o un líquido es necesario tener la masa y el volumen de este. Para este fin se utiliza la siguiente fórmula:
D = M / V
Generalmente las unidades de masa son gramos, sobre unidades de volumen ( cm3 , ml ) D = g / cm3Volumen
El volumen es el espacio que ocupa una porción de materia. En el sistema internacional de medidas ( S.I ), la unidad del volumen es el metro cúbico ( m3 ). En las prácticas el metro cúbico era demasiado para trabajar con líquidos, por esto se utiliza el litro, que es la unidad de patrón de volumen en el sistema métrico 1L = 1000 cm.3 1L …= 1000 ml …1 cm. 3 = 1 ml
Masa La masa es la cantidad de materia que posee un cuerpo. Se ha establecido como estándar de referencia el kilogramo ( Kg. ), la unidad de masa de mayor uso en el estudio de la química es el gramo ( g. ), el cual equivale a una milésima parte del kilogramo 1 Kg. = 1000 g. ….1 g. = 1000 mg.
¿Estados de agregación?
Aunque hemos visto que no toda la materia es igual, sino que está compuesta por diferentes sustancias con distintas propiedades características, toda la materia que vemos se presenta en tres formas distintas o estados de agregación: sólido, líquido o gaseoso.Sin embargo, el estado de agregación de una sustancia no es fijo, sino que depende de la temperatura a la que se encuentre. Así, normalmente el agua la vemos en estado líquido, pero si la metemos en el congelador, al bajar la temperatura por debajo de los 0 ºC, se congela y se convierte en hielo, que esagua en estado sólido. Si por el contrario la calentamos al fuego, hierve y se convierte en vapor de agua, se transforma al estado gaseoso. El punto de fusión y el punto de ebullición, propiedades características de las sustancias, son justamente las temperaturas a las que cambian de estado las diferentes sustancias.

Leyes de los gases
A modo de recordatorio. ¿Cuáles son los estados de la materia?: sólido, líquido y gaseoso, que dependen de la presión y de latemperatura a la que se encuentran sometidos.
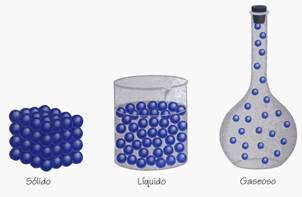 |
| Distintas materias, distintas fuerzas de cohesión molecular. |
En el estado sólido la fuerza de cohesión de las moléculas hace que estas estén muy próximas unas de otros con escaso margen de movimiento entre ellas.
En el estado líquido esta fuerza de cohesión molecular es menor lo cual permite mayor libertad de movimiento entre ellas.
En el estado gaseoso la fuerza de cohesión de las moléculas es muy pequeña, prácticamente nula, lo cual permite que estas se muevan libremente y en todas direcciones.
En este capítulo nos dedicaremos a estudiar este comportamiento de los gases para encontrar una explicación al mismo.
En este capítulo nos dedicaremos a estudiar este comportamiento de los gases para encontrar una explicación al mismo.
Antes de entrar de lleno en el estudio de las leyes que explican el comportamiento de los gases, veamos cómo influyen en este los eventos físicos que los alteran y que son: temperatura, presión y volumen, además de la cantidad de que se trate.
Temperatura
La temperatura (T) ejerce gran influencia sobre el estado de las moléculas de un gas aumentando o disminuyendo la velocidad de las mismas. Para trabajar con nuestras fórmulas siempre expresaremos la temperatura en grados Kelvin. Cuando la escala usada esté en grados Celsius, debemos hacer la conversión, sabiendo que 0º C equivale a + 273,15 º Kelvin.
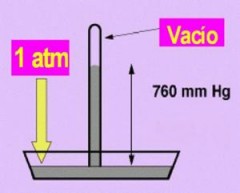 |
| 1 atm es igual a 760 mmHg de presión. |
Presión
En Física, presión (P) se define como la relación que existe entre unafuerza (F) y la superficie (S) sobre la que se aplica, y se calcula con la fórmula
Lo cual significa que la Presión (P) es igual a la Fuerza (F) aplicada dividido por la superficie (S) sobre la cual se aplica.
En nuestras fórmulas usaremos como unidad de presión la atmósfera (atm) y el milímetro de mercurio (mmHg), sabiendo que una atmósfera equivale a 760 mmHg.
En nuestras fórmulas usaremos como unidad de presión la atmósfera (atm) y el milímetro de mercurio (mmHg), sabiendo que una atmósfera equivale a 760 mmHg.
Ley de Boyle: Relaciona el volumen y la presión cuando la temperatura y el número de moles es constante. Nos dice que el volumen de un gas es inversamente proporcional a la presión, cuando se mantienen constantes la temperatura y el número de moles.
Ley de Charles/Gay Lussac: La ley enunciada por estos dos científicos nos dice que el volumen de un gas es directamente proporcional a la temperatura cuando P y n con constantes.
Ley de Avogadro: El volumen de un gas es directamente proporcional a número de moles cuando P y V son constantes.
Lo que nos permite deducir que volúmenes iguales de gases distintos tienen el mismo número de moléculas cuando P y T son constantes. O dicho de otro modo, el volumen de un número de moléculas es independiente de su identidad química. Se ha demostrado que el volumen en condiciones normales (0o C 1 at) de un mol de gas es 22’4 l.Estas tres leyes se engloban en la ley de los gases ideales, resumida en esta fórmula:
Ley de Charles
Relación entre la temperatura y el volumen de un gas cuando la presión es constante


En 1787, Jack Charles estudió por primera vez la relación entre el volumen y la temperatura de una muestra de gas a presión constante y observó que cuando se aumentaba la temperatura el volumen del gas también aumentaba y que al enfriar el volumen disminuía.
El volumen es directamente proporcional a la temperatura del gas: •Si la temperatura aumenta, el volumen del gas aumenta. •Si la temperatura del gas disminuye, el volumen disminuye. |
¿Por qué ocurre esto?
Cuando aumentamos la temperatura del gas las moléculas se mueven con más rapidez y tardan menos tiempo en alcanzar las paredes del recipiente. Esto quiere decir que el número de choques por unidad de tiempo será mayor. Es decir se producirá un aumento (por un instante) de la presión en el interior del recipiente y aumentará el volumen (el émbolo se desplazará hacia arriba hasta que la presión se iguale con la exterior).
Lo que Charles descubrió es que si la cantidad de gas y la presión permanecen constantes, el cociente entre el volumen y la temperatura siempre tiene el mismo valor.
Matemáticamente podemos expresarlo así:

(el cociente entre el volumen y la temperatura es constante)
Supongamos que tenemos un cierto volumen de gas V1 que se encuentra a una temperatura T1 al comienzo del experimento. Si variamos el volumen de gas hasta un nuevo valor V2, entonces la temperatura cambiará a T2, y se cumplirá:

que es otra manera de expresar la ley de Charles.
Esta ley se descubre casi ciento cuarenta años después de la de Boyle debido a que cuando Charles la enunció se encontró con el inconveniente de tener que relacionar el volumen con la temperatura Celsius ya que aún no existía la escala absoluta de temperatura.
Suscribirse a:
Entradas (Atom)