A modo de recordatorio. ¿Cuáles son los estados de la materia?: sólido, líquido y gaseoso, que dependen de la presión y de latemperatura a la que se encuentran sometidos.
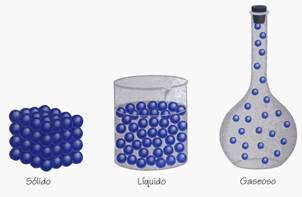 |
| Distintas materias, distintas fuerzas de cohesión molecular. |
En el estado sólido la fuerza de cohesión de las moléculas hace que estas estén muy próximas unas de otros con escaso margen de movimiento entre ellas.
En el estado líquido esta fuerza de cohesión molecular es menor lo cual permite mayor libertad de movimiento entre ellas.
En el estado gaseoso la fuerza de cohesión de las moléculas es muy pequeña, prácticamente nula, lo cual permite que estas se muevan libremente y en todas direcciones.
En este capítulo nos dedicaremos a estudiar este comportamiento de los gases para encontrar una explicación al mismo.
En este capítulo nos dedicaremos a estudiar este comportamiento de los gases para encontrar una explicación al mismo.
Antes de entrar de lleno en el estudio de las leyes que explican el comportamiento de los gases, veamos cómo influyen en este los eventos físicos que los alteran y que son: temperatura, presión y volumen, además de la cantidad de que se trate.
Temperatura
La temperatura (T) ejerce gran influencia sobre el estado de las moléculas de un gas aumentando o disminuyendo la velocidad de las mismas. Para trabajar con nuestras fórmulas siempre expresaremos la temperatura en grados Kelvin. Cuando la escala usada esté en grados Celsius, debemos hacer la conversión, sabiendo que 0º C equivale a + 273,15 º Kelvin.
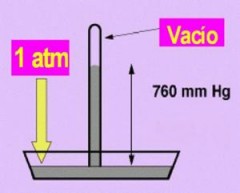 |
| 1 atm es igual a 760 mmHg de presión. |
Presión
En Física, presión (P) se define como la relación que existe entre unafuerza (F) y la superficie (S) sobre la que se aplica, y se calcula con la fórmula
Lo cual significa que la Presión (P) es igual a la Fuerza (F) aplicada dividido por la superficie (S) sobre la cual se aplica.
En nuestras fórmulas usaremos como unidad de presión la atmósfera (atm) y el milímetro de mercurio (mmHg), sabiendo que una atmósfera equivale a 760 mmHg.
En nuestras fórmulas usaremos como unidad de presión la atmósfera (atm) y el milímetro de mercurio (mmHg), sabiendo que una atmósfera equivale a 760 mmHg.
Ley de Boyle: Relaciona el volumen y la presión cuando la temperatura y el número de moles es constante. Nos dice que el volumen de un gas es inversamente proporcional a la presión, cuando se mantienen constantes la temperatura y el número de moles.
Ley de Charles/Gay Lussac: La ley enunciada por estos dos científicos nos dice que el volumen de un gas es directamente proporcional a la temperatura cuando P y n con constantes.
Ley de Avogadro: El volumen de un gas es directamente proporcional a número de moles cuando P y V son constantes.
Lo que nos permite deducir que volúmenes iguales de gases distintos tienen el mismo número de moléculas cuando P y T son constantes. O dicho de otro modo, el volumen de un número de moléculas es independiente de su identidad química. Se ha demostrado que el volumen en condiciones normales (0o C 1 at) de un mol de gas es 22’4 l.Estas tres leyes se engloban en la ley de los gases ideales, resumida en esta fórmula:
No hay comentarios:
Publicar un comentario